テーマ: 化学 今日は、前回掲載した覚えなければいけない有機化合物の名前と構造式 「 センター試験徹底分析チャート 」より の解答です。 覚えなければいけない有機化合物の名前と構造式 (脂肪族編) 覚えなければいけない有機化合物の名前と構造式CH 3 CH(OH)COOH 2ヒドロキシプロパン酸 2hydroxypropanoic acid 乳酸 lactic acid 9008 53 122 386 一価の酸,発酵した乳製品,筋肉疲労物質,水可溶。 HOOC CH(OH)CH 2 COOHPニトロ安息香酸 pnitrobenzoic acid $_\ce{no2c6h4cooh}_$ (3)1505 詳細はこちら アジピン酸 adipic acid $_\ce{hooc(ch2)4cooh}_$ (2)858 詳細はこちら アゼライン酸 azelaic acid $_\ce{hooc(ch2)7cooh}_$ 1 (2

化学式
酸 塩基 化学式 一覧
酸 塩基 化学式 一覧-Google Image Searchによる検索結果: 染料 | dyeing 本間善夫・川端潤,「パソコンで見る動く分子事典」,pp,講談社ブルーバックス(07) 結合の種類の例(アミノ酸を例に) 酸化 さんか ( 燃焼 ねんしょう )の化学反応式一覧 酸化とは :物質が酸素と化合すること。 酸化の中でも、熱や光を発しながら激しく酸化することを燃焼という。 水素の燃焼(水の合成) 2H2 O2 → 2H2O 水素が酸化して水になる。 炭素の完全燃焼 C O2 → CO2 炭素が酸化して二酸化炭素になる。




元素 化合物の種類と化学式の一覧 いちらん屋 一覧屋
カルボン酸 カルボン酸の一覧 飽和脂肪酸炭素数慣用名IUPAC名化学式存在・用途1ギ酸メタン酸 HCOOH {\displaystyle {\ce {HCOOH}}} アリ、ハチの毒2酢酸エタン酸 CH 3 COOHC≡CH 2Ag → AgC≡CAg↓ (白) 2H HC≡CH 2 Ag (NH 3) 2 NO 3 → AgC≡CAg 2HNO 3 4NH 3 トレンス試薬は銀鏡反応にも用いられる アンモニア性塩化銅 (I) 水溶液 アセチレン → 銅アセチリド (赤褐色沈殿) HC≡CH 2Cu → CuC≡CCu↓ (赤褐) 2H HC≡CH 2 Cu (NH 3) 4 Cl → CuC≡CCu 8NH 3 2HCl アンモニア性塩化銅 (Ⅰ)溶液にアセチレンを溶かした時の反応式を教え日本大百科全書(ニッポニカ) サリチル酸の用語解説 化学式はC6H4(OH)COOHで、o(オルト)ヒドロキシ安息香酸の別名。 加熱・加圧下でナトリウムフェノキシドと二酸化炭素を反応させて製造する。この反応をコルベ‐シュミットKolbeSchmitt反応という。分子量1381、融点159℃。
酢酸の化学式はC2H4O2、水の化学式はH2Oですが、それぞれの分子式、組成式を求めてみましょう。 酢酸は分子なので分子式があり、化学式と同じC2H4O2になります。 より構造がよくわかるようにCH3COOHという書き方をする場合もありますが、特に問題文中に指示がない場合には、どちらを答えても大丈夫です。 一方、組成式は、C2H4O2ではありません。 炭素、水素、酸主なところでは,C (炭素),H (水素),O (酸素),N (窒素),P (リン),S (イオウ),ハロゲン(フッ素 (F)・塩素 (Cl)・臭素 (Br)・ヨウ素 (I)など)などです。 ところで有機化合物の数は00万種を超えているともいわれています。えば、下の反応式では、h 2oがhを受け取っているから、h 2oは塩基として働いてい る。 また、多くの酸塩基反応は可逆であり、速やかに平衡に達することが多い。このこと を明記するため、酸塩基反応を書く場合は、「化学平衡を表す両矢印」を使う(注3)。
フッ化水素 hf 1価の酸 塩化水素 hcl 臭化水素 hbr ヨウ化水素 hi 硝酸 hno 3 酢酸 ch 3 cooh 硫酸 h 2 so 4 2価の酸 シュウ酸 (cooh) 2 二酸化炭素 co 2 硫化水素 h 2 s リン酸 h 3 po 4 3価の酸 水酸化ナトリウム naoh 1価の塩基 水酸化カリウム koh アンモニア nh 3 水酸化カルシウム ca(oh) 2 2価の塩基 イオン式の一覧を中学生向けに作成 しました。 さっそくイオン式の一覧を下に載せますが、 その下にはさらに、 化学式やイオン式の確認と解説 や イオン式の練習問題 も作ったので、ぜひ勉強に活用してください! 陽イオン 赤字がよく出るもの 水素化学式 IUPAC 名 慣用名 モル質量 g /mol 融点 ℃ 沸点 ℃ pKa 備 考;



3章 イオン結合とイオン結晶 最終回 3 2 イオン結晶の構造 Ppt Download



リン酸ナトリウム You Iggy
212 入試頻出の3大オキソ酸の化学式(分子式と構造式) 213 天然高分子の分子式と構造式;高校化学で覚えるべき原子量一覧 原子量とは、原子の重さのことです。 ただし同位体(同じ原子で異なる中性子を持つもの)があるときは、その存在比率を考慮した平均値を重さとします。 原子量はあくまでも相対的な数値です。 原子はとても軽いの化学式・・・銅 (Cu), 酸素 (O2)、酸化銅 (CuO)



リン酸鉄 Ii You Iggy




h30センター化学第6問 問1 アクリル酸 メタクリル酸 メタクリル酸メチルの語呂合わせ 入試化学を語呂合わせで解く大学入試ゴロ化学
CH 3 COOH(酢酸)→ H CH 3 COO - H 2 SO 4 (硫酸)→ 2H SO 42- 2価 H 2 CO 3 (炭酸)→ 2H CO 32- H 2 S(硫化水素)→ 2H S 2- H 2 C 2 O 4 (シュウ酸)→ 2H C 2 O 42- または (COOH) 2 (シュウ酸)→ 2H (COO) 22- 3価 H 3 PO 4 (リン酸)→ 3H PO 43-高校化学で試験によく出る酸化剤と還元剤をまとめました。 酸化剤一覧 塩素 Cl 2 Cl 2 2e→ 2Cl酸素 O 2 O 2 4H 4e→ 2H 2 O オゾン O 3 O 3 2H 2e→ O 2 H 2 O 過酸化水素 H 2 O 2 H 2 O 2 2H 2e→ 2H 2 O 酸化マンガン(Ⅳ) MnO 2 MnO 2 4H 2e→ Mn 2 2H 2 O 過フッ化物イオン塩化物イオン臭化物イオンヨウ化物イオン酸化物イオン炭酸イオンF 炭酸水素イオンCl 硫酸イオンBr 硫酸水素イオンI 酢酸イオンO2 リン酸イオン NH4




化学式の一覧や覚え方 中学生が覚えておきたい化学式 三重の個人契約家庭教師




高校無機化学 錯イオンの配位子 配位数 立体構造 名称 錯イオン形成反応 受験の月
有機化学の記事一覧 石けんについて、知っているようで知らない・理解し辛い「仕組み・製法」や「けん化・高級脂肪酸のグリセリンエステル」・ミセルなどについて図解していきます。 芳香族化合物の種類と特徴などをまとめて解説・整理しました(官能基): 有機化学 官能基(特有な性質を示す基)functional groups 化合物の例 名称 (水溶性) 構造 一般名 特徴 名称 化学式 ヒドロキシル基(オ) (水酸基) アルコール:(中性) hydroxy group -OH ROH アルコール (R炭化水素基) ・Naと反応して H2 発生 ・無水酢酸 (CH3CO)2Oで中和反応の計算 酸と塩基が過不足なく中和するためには、酸が出す水素イオンH+と塩基の出す水酸化物イオンOH-の数が等しい必要があります。 ただし、このときに酸と塩基の価数に注意する必要があります。 例えば1molの水酸化ナトリウムを中和さ




無機化学のまとめと効率的暗記 化学反応式のまとめ 耳たこ高校化学暗記帳




化学式 イオン式 一覧 中学生 理科のノート Clear
化学式 分子量 cas番号 官報公示整理番号; HCl(塩酸)→ H Cl - HBr(臭化水素酸)→ H Br - HI(ヨウ化水素酸)→ H I - HNO 3 (硝酸)→ H NO 3- 1価 HF(フッ化水素酸)→ H F - CH 3 COOH(酢酸)→ H CH 3 COO - H 2 SO 4 (硫酸)→ 2H SO 42- 2価 H 2 CO 3 (炭酸)→ 2H CO 32- H 2 S(硫化水素)→ 2H S 2- H 2 C 2 O 4 (シュウ酸)→ 2H C 2 O 42- または (COOH) 酸塩基インジケータ重要ポイント 酸塩基指示薬は、水溶液は酸性、中性、又はアルカリ性であるかどうかを決定するために使用される化学物質です。 酸味及びアルカリはpHに関連しているため、それらはpH指示薬として知られています。 酸塩基指示薬の例




電池の正極の見分け方 実用電池のまとめ 語呂合わせで高校化学 大学入試ゴロ化学



3
気体の発生の化学反応式 酸と金属の反応、酸と石灰石の反応などです。質量保存の法則でよく登場します。 塩酸とマグネシウムの反応 塩酸+マグネシウム→塩化マグネシウム+水素 2HCl+Mg→MgCl₂+H₂ 塩酸と炭酸カルシウムの反応はじめに 化学の問題では、様々な酸性の物質や塩基性の物質が登場します。 みなさんは問題を解く上で、それらを強酸か弱酸か、または強塩基か弱塩基なのかを判断しなければなりません。 ここでは、頻出する代表的な酸性物質、塩基性物質をまとめてみました。 酢酸+水酸化カルシウム→酢酸カルシウム+水 2CH3COOH Ca (OH)2 → (CH3COO)2Ca 2H2O 酢酸+アンモニア水→酢酸アンモニウム+水 CH3COOH NH4OH → CH3COONH4 H2O 21 炭酸水+水酸化ナトリウム→炭酸ナトリウム+水 H2CO3 2NaOH → Na2CO3 2H2O 22



Search Q E6 8b E9 80 A0 E5 8f E4 B8 80 E8 A6 Tbm Isch




元素 化合物の種類と化学式の一覧 いちらん屋 一覧屋
アミノ酸とは何か簡単に解説! アミノ酸は「 アミン(ーnh2) 」と「 酸 (cooh) 」からできている物質です。 アミノ酸はたくさんの種類がありますが、基本的には上の構造のrの部分が変化するだけです。 rがhになったものはグリシン、メチル基(me)はアラニンなどrの部分が変化してアミノ酸 固体のクエン酸には、「 無水物 むすいぶつ 」と「 一水和物 いちすいわぶつ/いっすいわぶつ 」が存在します。 無水クエン酸 とは、クエン酸分子のみでできた固体(化学式:C 6 H これらに対して、リン酸基、アルコール、スフィンゴイド塩基、糖類、アルコール、イソプレンなどが結合して様々な脂質のバリエーションが生まれます。 多くの脂質はエステルといって、カルボン酸とアルコール ーOHがくっついた形をしています。 私達が普段目にする食用油脂 (オリーブ油やバター)は①アシルグリセロール (トリグリセリド)です。 トリ



ヘリウム 化学式



化学式とは その意味から大学受験に役立つ化学反応式の覚え方まで Studyplus スタディプラス
覚えなくていい? 高校化学の化学式一覧 21 分子式一覧 211 超基本的な有機物脂肪族の分子式と構造式; 高級脂肪酸とは 高級脂肪酸とは、油脂やロウの主要成分のひとつで、たとえば植物油脂は化学構造的に、 1つのグリセリンと3つの高級脂肪酸で構成されており、この油脂を加水分解することで得られるほか化学合成によっても得られます。 また高級脂肪酸とは、分子の中に炭素を12個以上
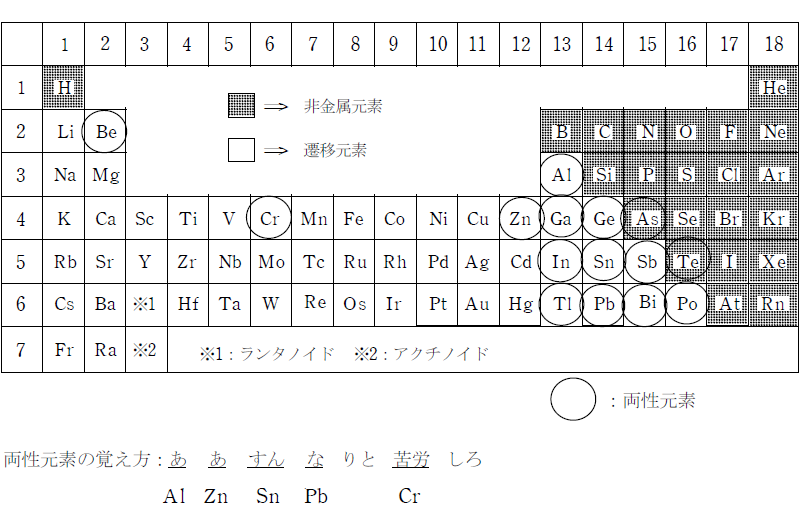



無機化学 第9回 両性元素 Al 医学部受験を決めたら 私立 国公立大学医学部に入ろう ドットコム



化学反応式覚え方 至急お願いします 下の写真の化学反応式を全て覚えなけれ Yahoo 知恵袋




楽天市場 お風呂 化学式の通販




酸 塩基 価数 一覧 覚え方 例など 化学のグルメ




完全版 酸 塩基の価数の意味 覚え方 一覧と多段階電離 サイエンスストック 高校化学をアニメーションで理解する



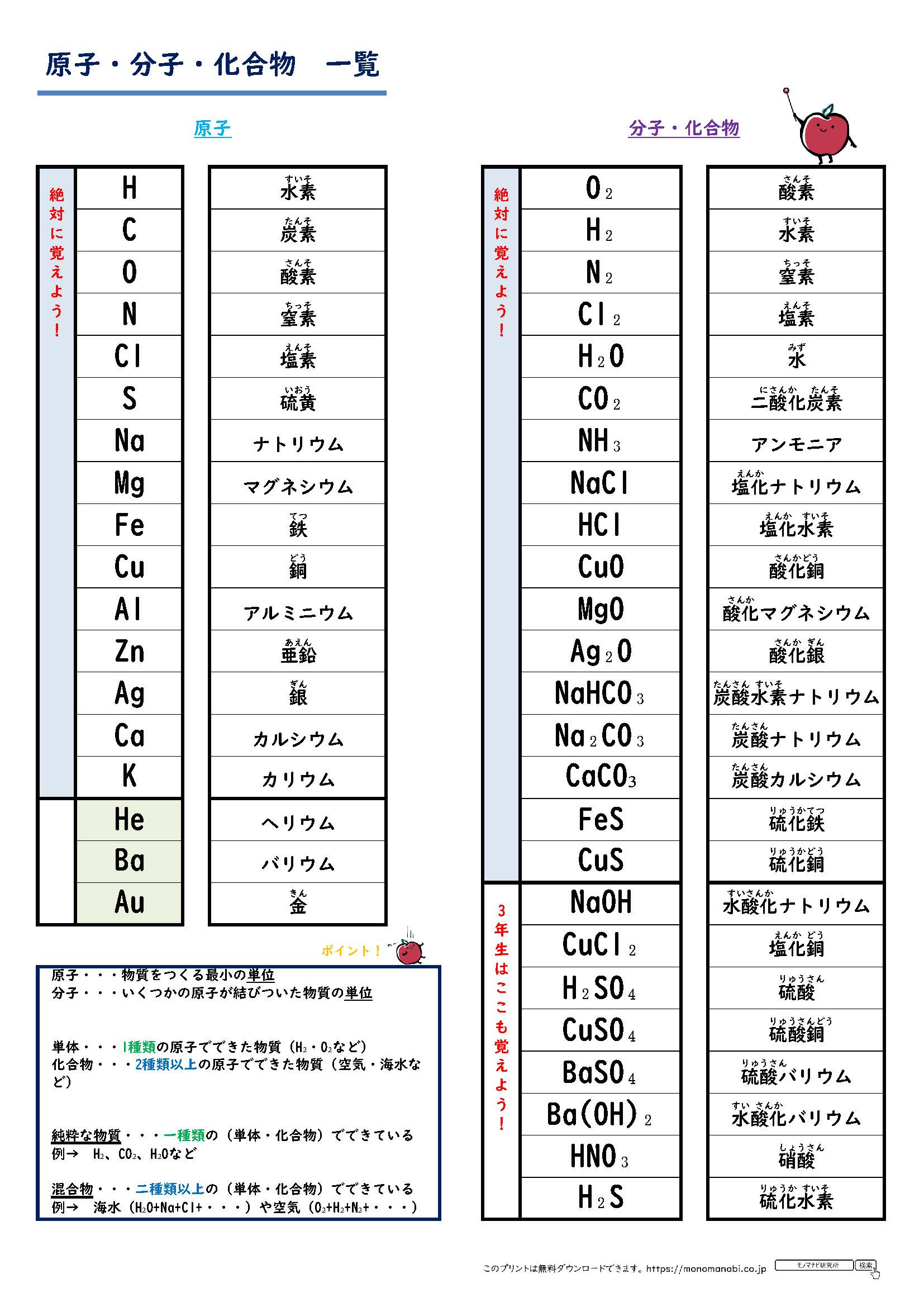
モノマナビ研究所




塩の加水分解 理系ラボ




化学式の一覧や覚え方 中学生が覚えておきたい化学式 三重の個人契約家庭教師




イオン式 電離式まとめ 中学理科 ポイントまとめと整理




化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた 化学受験テクニック塾



我々が知る限り最強の8つの 酸 Seleqt セレキュト Seleqt セレキュト



3




半反応式の作り方を解説 酸化剤 還元剤の見分け方と一覧表も 高校生向け受験応援メディア 受験のミカタ



1
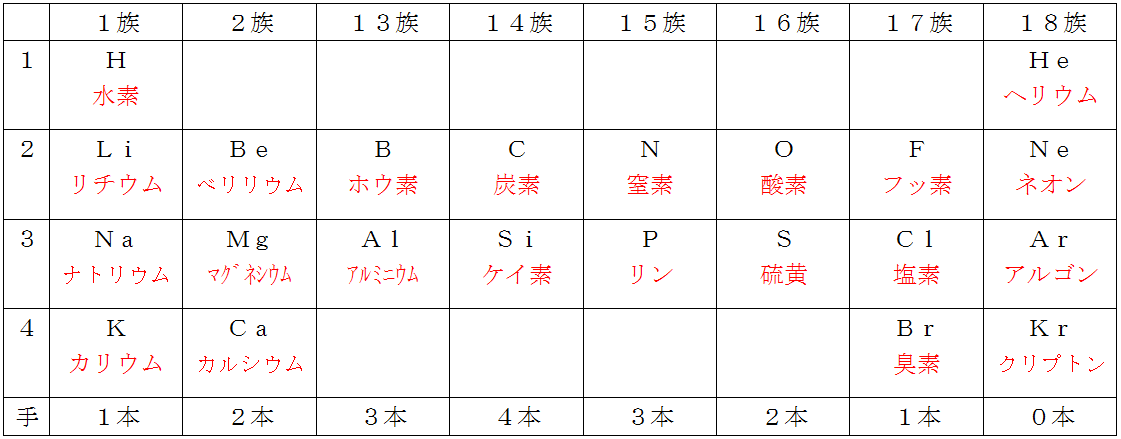



理科4ページ目 三重の個人契約家庭教師




化学式 English Books英語教材専門店proceedx




6 1 酸と塩基 おのれー Note




中学理科 高校入試 化学反応式一覧まとめと問題




Images Of イオン反応式 Japaneseclass Jp




化学 酸 塩基の化学式 カード暗記 高校生 化学のノート Clear




化学式の一覧や覚え方 中学生が覚えておきたい化学式 三重の個人契約家庭教師
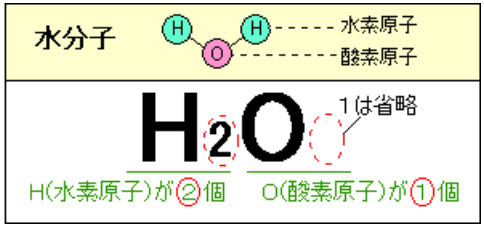



化学式の一覧や覚え方 中学生が覚えておきたい化学式 三重の個人契約家庭教師




日本石鹸洗剤工業会 石けん洗剤知識
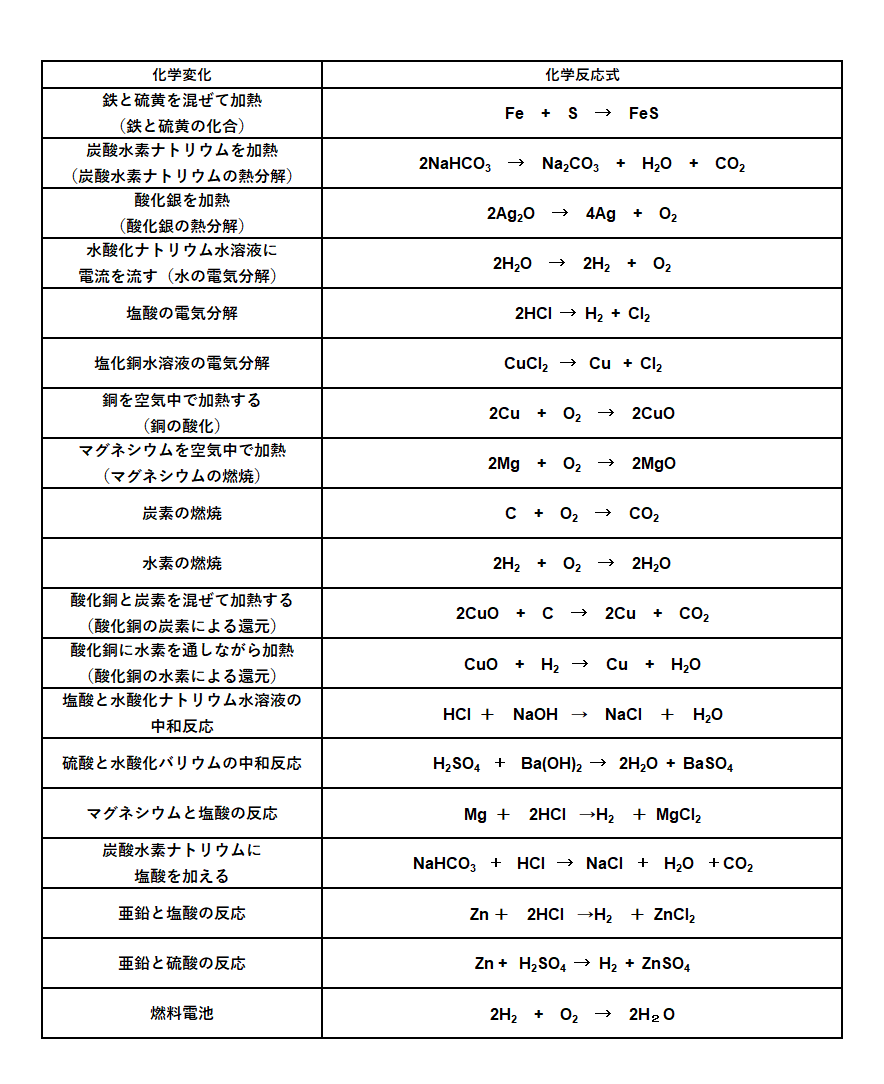



中2化学 化学反応式 中学理科 ポイントまとめと整理
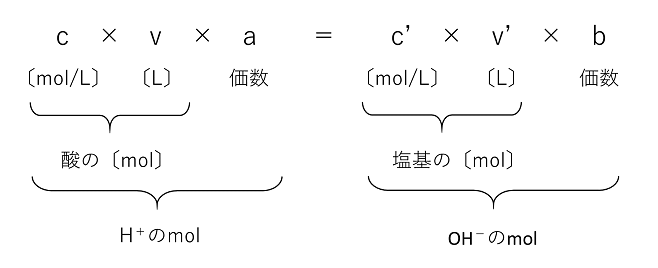



中 和 反応 式 原子核物理の基礎 3 核反応 03 Documents Openideo Com




高校化学基礎 酸と塩基の価数と強弱 映像授業のtry It トライイット




ヤフオク 化学式の中古品 新品 未使用品一覧
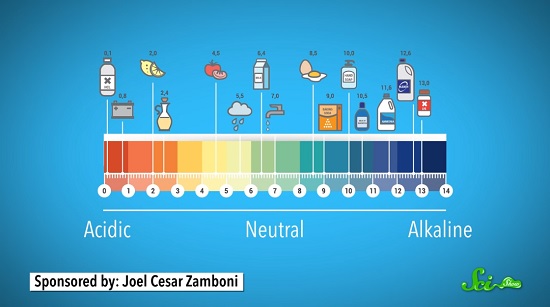



硫酸の1京倍強いフルオロ酸の威力 ログミーbiz



電離式の小テスト 3年理科 Takaの授業記録11




化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた 化学受験テクニック塾




高1 強酸 強塩基 弱酸 弱塩基の分類一覧 高校生 化学のノート Clear
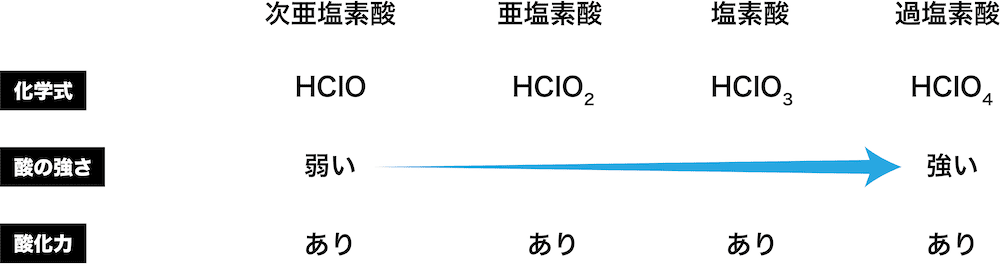



オキソ酸 例 酸化力 一覧 強さ 構造 酸化数など 化学のグルメ



5分でわかる 中和反応とは 化学反応式と計算問題の解き方 練習問題付き サイエンスストック 高校化学をアニメーションで理解する




化学式 Wikipedia




フライング エッグ株式会社 今回の開発商品ポスターは 化学式一覧表 です Facebook




高校生物 クエン酸回路 映像授業のtry It トライイット
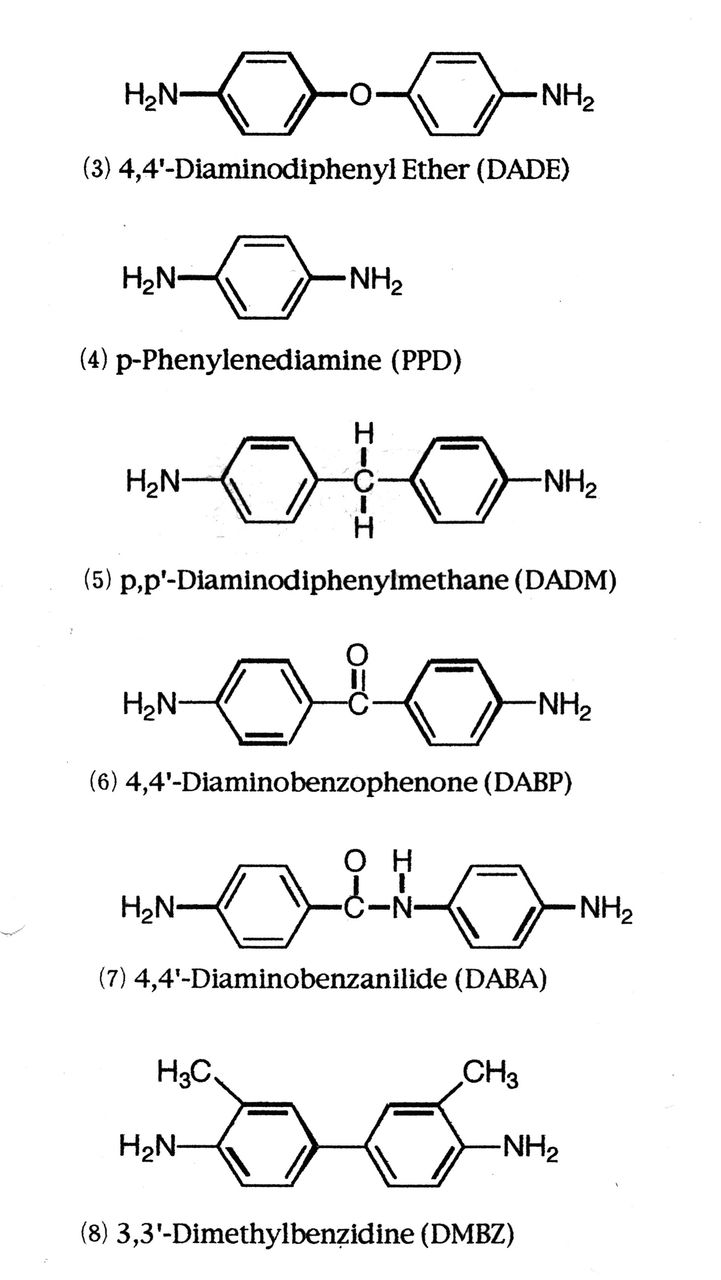



高分子 ミクロの世界




化学式 組成式 分子式 示性式 構造式の違いと見分け方を具体例で解説
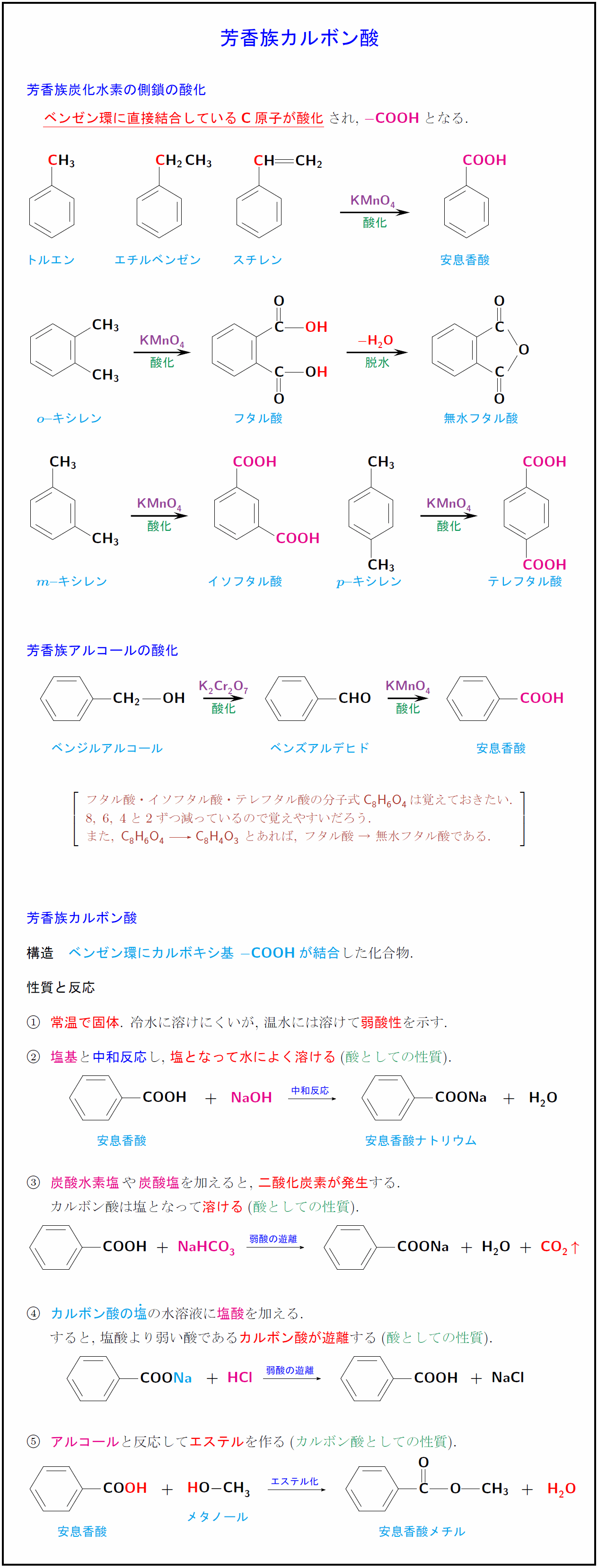



高校有機化学 芳香族カルボン酸 安息香酸 フタル酸 の構造 性質 反応まとめ 受験の月




絶対忘れない 強酸 強塩基のゴロ合わせ Youtube




高校化学 酸化物の分類 映像授業のtry It トライイット




モノマナビ研究所



化学式の一覧や覚え方 中学生が覚えておきたい化学式 三重の個人契約家庭教師




モノマナビ研究所




試験 テストに出る化学反応式一覧 中学理科 高校入試の要点まとめ Yattoke 小 中学生の学習サイト




化学式



酸 塩基 塩基の価数と強弱は周期表でおさえる 基本に忠実に本質を伝える 楽天ブログ
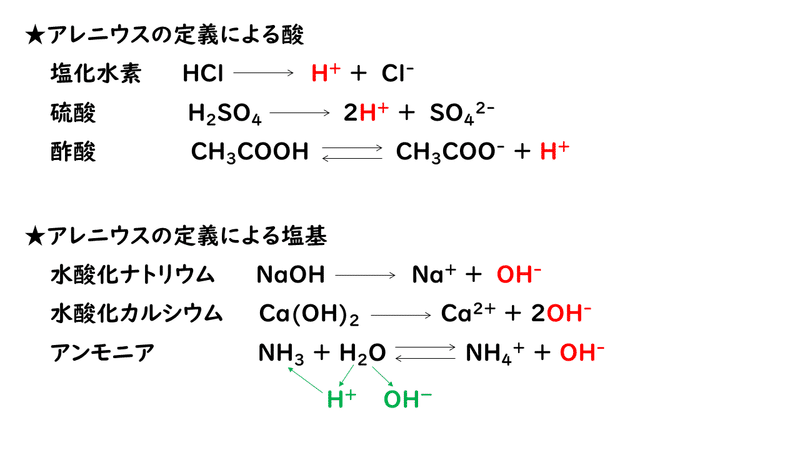



6 1 酸と塩基 おのれー Note




酸 塩基の価数の意味 覚え方 一覧と多段階電離 Vicolla Magazine



酸 塩基 価数 一覧 覚え方 例など 化学のグルメ




中学理科 高校入試 化学反応式一覧まとめと問題



ゴロでも何でもいいので 高度さらし粉の 化学式の覚え方を教えてください Yahoo 知恵袋



永久保存版 無機化学の反応はたった6つ 受験メモ




センター試験にでる化学反応式 数学 化学講師 佐藤学による受験生に役立つ濃縮ポイントと Etc




酸化剤 還元剤の半反応式一覧 4ステップで半反応式は書ける



化合物一覧 List Of Compounds Japaneseclass Jp




エタノールの化学式の覚え方
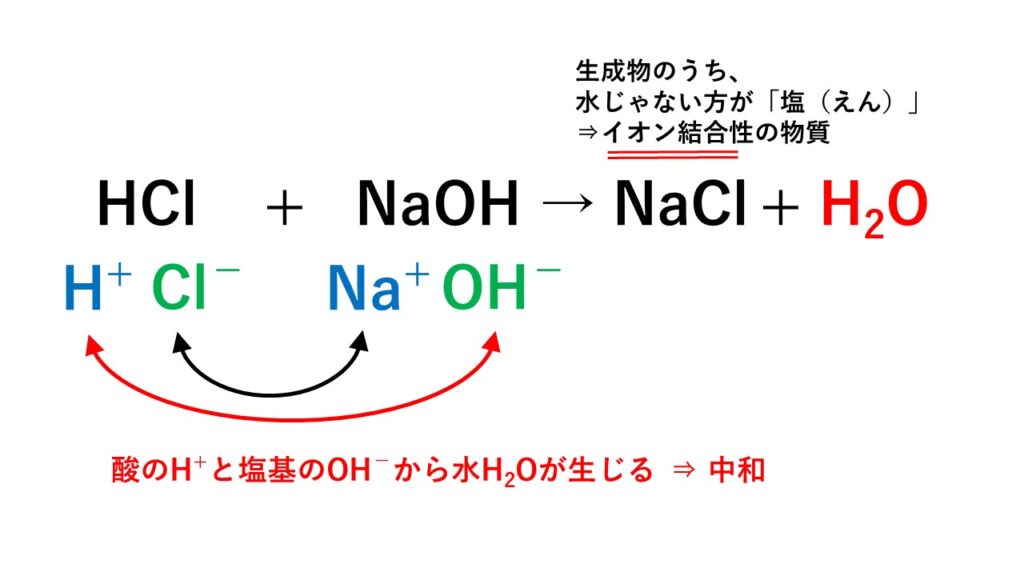



5分でわかる 中和反応とは 化学反応式と計算問題の解き方 練習問題付き サイエンスストック 高校化学をアニメーションで理解する



ここにある化学式の簡単な覚え方 語呂合わせなど ってありませんか Yahoo 知恵袋




中和反応式 一覧 中和反応でできる 塩の種類と性質 中学理科 Yattoke 小 中学生の学習サイト



1 重曹って何だろう クエン酸って何だろう 重曹 クエン酸で地球に優しいお掃除はじめませんか 木曽路物産株式会社




高校無機化学 揮発性酸の遊離反応 受験の月




化学品のhsコード検索 関税削減 Com Hsコード分類事例の解説




高校化学が苦手な受験生必見 化学反応式の覚え方のコツをご紹介 予備校いくなら逆転合格の武田塾




強酸と弱酸まとめ 見分け方 理系ラボ



リン酸 You Iggy



無機化合物一覧 For Android Apk Download



化学式とは その意味から大学受験に役立つ化学反応式の覚え方まで Studyplus スタディプラス



ピクリン酸 化学式ピアス 片耳 Iichi ハンドメイド クラフト作品 手仕事品の通販




理科 化学反応式 電離式覚えよう 中学生 理科のノート Clear



酸化還元反応を解説 酸化数を理解して半反応式を覚えよう Studyplus スタディプラス




フライング エッグ株式会社 今回の開発商品ポスターは 化学式一覧表 です Facebook




イオン式 化学式 電離 電気分解まとめ 中学生 理科のノート Clear




Amazon お風呂学習ポスター 受験教材 化学式一覧表 化学 おもちゃ
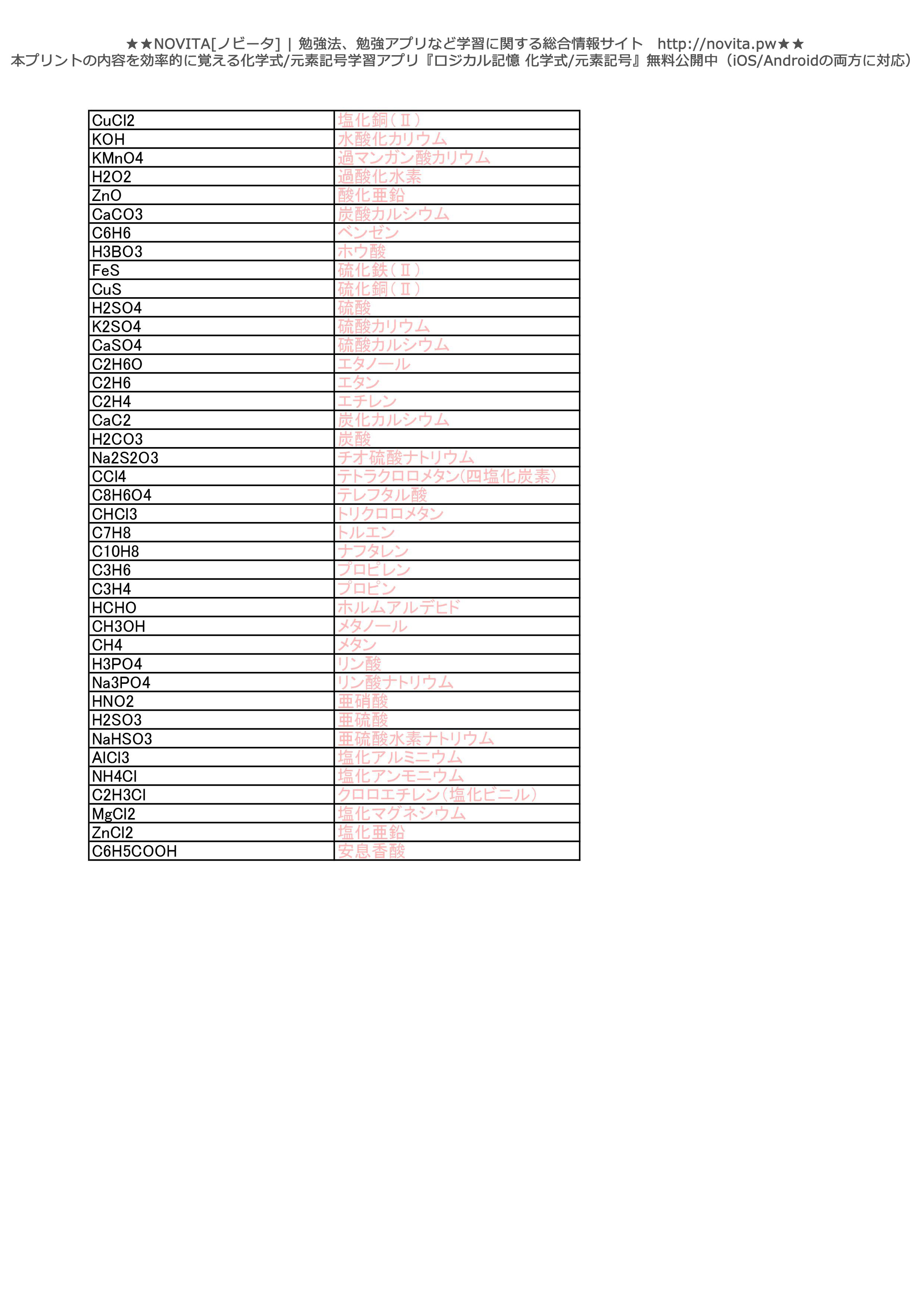



元素記号 化学式 勉強プリント Novita 勉強法



主な化学反応式一覧 中学理科で登場する化学反応式のまとめ 教科書をわかりやすく通訳するサイト




化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた 化学受験テクニック塾




セ対 これだけは覚える 化学式一覧 高校生 化学のノート Clear




高校化学 マレイン酸とフマル酸 映像授業のtry It トライイット




化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた 化学受験テクニック塾




高校化学基礎 単原子イオンと多原子イオン 映像授業のtry It トライイット




高校化学基礎 イオン化傾向と金属単体の反応性 映像授業のtry It トライイット



ルテイン 化学式 構造式 一覧 Jack Katie




高校化学基礎 電離度とは 映像授業のtry It トライイット




高校化学 十酸化四リンとリン酸 映像授業のtry It トライイット




セ対 これだけは覚える 化学式一覧 高校生 化学のノート Clear




化学の暗記におすすめの語呂合わせを一挙紹介 大学受験プロ




化学式 イオン式 一覧 中学生 理科のノート Clear




日本石鹸洗剤工業会 石けん洗剤知識




トップ 100 化合物 化学式 一覧 マインクラフトの最高のアイデア



0 件のコメント:
コメントを投稿